24.02.2026 à 17:03
L’« IA edge », qu’est-ce que c’est et à quoi ça sert ?
Georgios Bouloukakis, Assistant Professor, University of Patras; Institut Mines-Télécom (IMT)
Texte intégral (2391 mots)

Pour analyser les énormes volumes de données, notamment ceux générés par les nombreux capteurs qui peuplent désormais nos vies – du lave-vaisselle à la voiture, sans parler de nos téléphones –, on les envoie sur le cloud. Pour permettre des calculs plus rapides et plus sécurisés, l’edge computing se développe. Son pendant IA est l’edge AI (en anglais), une manière de faire de l’IA sans recourir au cloud. Explications d’un spécialiste.
Les capteurs nous accompagnent partout : dans les maisons, dans les bureaux, à l’hôpital, dans les systèmes de transport et à la ferme. Ils offrent la possibilité d’améliorer la sécurité publique et la qualité de vie.
L’« Internet des objets » (IoT en anglais, pour Internet of Things) inclut les capteurs de température et de qualité de l’air qui visent à améliorer le confort intérieur, les capteurs portables pour surveiller la santé, les lidars et les radars pour fluidifier le trafic ainsi que les détecteurs permettant une intervention rapide lors d’un incendie.
Ces dispositifs génèrent d’énormes volumes de données, qui sont utilisées pour entraîner des modèles d’intelligence artificielle. Ceux-ci apprennent un modèle de l’environnement opérationnel du capteur afin d’en améliorer les performances.
Par exemple, les données de connectivité provenant des points d’accès wifi ou des balises Bluetooth déployés dans les grands bâtiments peuvent être analysées à l’aide d’algorithmes d’IA afin d’identifier les modèles d’occupation et de mouvement à différentes périodes de l’année et pour différents types d’événements, en fonction du type de bâtiment (par exemple, bureau, hôpital ou université). Ces modèles peuvent ensuite être exploités pour optimiser le chauffage, la ventilation, les évacuations, etc.
Combiner l’Internet des objets et l’intelligence artificielle s’accompagne de défis techniques
L’ « intelligence artificielle des objets » (AIoT, en anglais) combine l’IA et l’IoT. Il s’agit de mieux optimiser et automatiser les systèmes interconnectés, et d’ouvrir la voie à une prise de décision intelligente. En effet, les systèmes AIoT s’appuient sur des données réelles, à grande échelle, pour améliorer la précision et la robustesse de leurs prédictions.
Mais pour tirer des informations des données collectées par les capteurs IoT, celles-ci doivent être collectées, traitées et gérées efficacement.
Pour ce faire, on utilise généralement des « plateformes cloud » (par exemple, Amazon Web Services, Google Cloud Platform, etc.), qui hébergent des modèles d’IA à forte intensité de calcul – notamment les modèles de fondations récents.
Que sont les modèles de fondation ?
- Les modèles de fondation sont un type de modèles d’apprentissage automatique entraînés sur des données généralistes et conçus pour s’adapter à diverses tâches en aval. Ils englobent, sans s’y limiter, les grands modèles de langage (LLM), qui traitent principalement des données textuelles, mais aussi les modèles dits « multimodaux » qui peuvent travailler avec des images, de l’audio, de la vidéo et des données chronologiques.
- En IA générative, les modèles de fondation servent de base à la génération de contenus (textes, images, audio ou code).
- Contrairement aux systèmes d’IA conventionnels qui s’appuient sur des ensembles de données spécifiques à une tâche et sur un prétraitement approfondi, les modèles de fondation ont la capacité d’apprendre sur la base de peu ou pas d’exemples (on parle respectivement de « few-shot learning » et de « zero-shot learning »). Ceci leur permet de s’adapter à de nouvelles tâches et de nouveaux domaines avec un minimum de personnalisation.
- Bien que les modèles de fondation en soient encore à leurs débuts, ils ont un grand potentiel de création de valeur pour les entreprises de tous les secteurs : leur essor marque donc un changement de paradigme dans le domaine de l’intelligence artificielle appliquée.
Les limites du cloud pour traiter les données de l’IoT
L’hébergement de systèmes lourds d’IA ou de modèles de fondation sur des plateformes cloud offre l’avantage de ressources informatiques abondantes, mais il présente également plusieurs limites.
En particulier, la transmission de grands volumes de données IoT vers le cloud peut augmenter considérablement les temps de réponse des applications AIoT, avec des délais allant de quelques centaines de millisecondes à plusieurs secondes selon les conditions du réseau et le volume de données.
De plus, le transfert de données vers le cloud, en particulier d’informations sensibles ou privées, soulève des questions de confidentialité. On considère généralement que l’idéal pour la confidentialité est de traiter localement les données, à proximité des utilisateurs finaux, pour limiter les transferts.
Par exemple, dans une maison intelligente, les données provenant des compteurs intelligents ou des commandes d’éclairage peuvent révéler des habitudes d’occupation ou permettre la localisation à l’intérieur (par exemple, détecter qu’Hélène est généralement dans la cuisine à 8 h 30 pour préparer le petit-déjeuner). Il est préférable que ces déductions se fassent à proximité de la source de données afin de minimiser les retards liés à la communication entre l’edge et le cloud, et afin de réduire l’exposition des informations privées sur les plateformes cloud tierces.
À lire aussi : Calculs sur le cloud : comment stocker et exploiter les données de façon sûre… et pas trop onéreuse
Qu’est-ce que l’« edge computing » et l’« edge AI » ?
Pour réduire la latence et améliorer la confidentialité des données, l’edge computing est une bonne option, car il fournit des ressources informatiques (c’est-à-dire des appareils dotés de capacités de mémoire et de traitement) plus proches des appareils IoT et des utilisateurs finaux, généralement dans le même bâtiment, sur des passerelles locales ou dans des microcentres de données à proximité.
Cependant, ces ressources dites « périphériques » (edge) sont nettement plus limitées en termes de puissance de traitement, de mémoire et de stockage que les plateformes cloud centralisées, ce qui pose des défis pour le déploiement de modèles d’IA complexes dans des environnements distribués.
Le domaine émergent de l’edge AI, particulièrement actif en Europe, cherche à y remédier pour une exécution efficace de tâches d’IA sur des ressources plus frugales.
L’une de ces méthodes est le split computing, qui partitionne les modèles d’apprentissage profond entre plusieurs nœuds au sein d’un même espace (par exemple, un bâtiment), ou même entre différents quartiers ou villes.
La complexité augmente encore avec l’intégration des modèles de fondation, qui rendent la conception et l’exécution des stratégies de split computing encore plus difficile.
Quels changements cela implique-t-il en termes de consommation d’énergie, de confidentialité et de vitesse ?
L’edge computing améliore considérablement les temps de réponse en traitant les données plus près des utilisateurs finaux, éliminant ainsi la nécessité de transmettre les informations à des centres de données cloud éloignés. Cette approche améliore également la confidentialité, en particulier avec l’avènement des techniques d’edge AI.
Par exemple, l’apprentissage fédéré permet de former des modèles d’apprentissage automatique directement sur des appareils locaux, voire directement sur de nouveaux appareils IoT. En effet, ceux-ci sont dotés de capacités de traitement, garantissant ainsi que les données brutes restent sur l’appareil tandis que seules les mises à jour des modèles d’IA sont transmises aux plateformes edge ou cloud, où ils peuvent être agrégés et passer la dernière phase d’entraînement.
La confidentialité est également préservée pendant l’inférence. En effet, une fois entraînés, les modèles d’IA peuvent être déployés sur les ressources de calcul distribuées (à l’edge), ce qui permet de traiter les données localement sans les exposer aux infrastructures du cloud.
C’est particulièrement utile pour les entreprises qui souhaitent exploiter les grands modèles de langage au sein de leurs infrastructures. Par exemple, ceux-ci peuvent être utilisés pour répondre à des requêtes sur l’état de fonctionnement des machines industrielles, la prévision des besoins de maintenance à partir des données des capteurs – des points qui utilisent des données sensibles et confidentielles. Le fait de conserver les requêtes et les réponses au sein de l’organisation permet de protéger les informations sensibles et de se conformer aux exigences en matière de confidentialité et de conformité.
Comment ça marche ?
Contrairement aux plateformes cloud matures, comme Amazon Web Services et Google Cloud, il n’existe actuellement aucune plateforme bien établie pour prendre en charge le déploiement à grande échelle d’applications et de services edge.
Cependant, les fournisseurs de télécommunications commencent à exploiter les ressources locales existantes sur les sites d’antennes afin d’offrir des capacités de calcul plus proches des utilisateurs finaux. La gestion de ces ressources distribuées reste difficile en raison de leur variabilité et de leur hétérogénéité, impliquant souvent de nombreux serveurs et appareils de faible capacité.
À mon avis, la complexité de la maintenance est un obstacle majeur au déploiement des services d’edge AI. Mais le domaine progresse rapidement, avec des pistes prometteuses pour améliorer l’utilisation et la gestion des ressources distribuées.
Allocation des ressources à travers le continuum IoT-Edge-Cloud pour des applications AIoT sûres et efficaces
Afin de permettre un déploiement fiable et efficace des systèmes AIoT dans les espaces intelligents (tels que les maisons, les bureaux, les industries et les hôpitaux), notre groupe de recherche, en collaboration avec des partenaires à travers l’Europe, développe un cadre basé sur l’IA dans le cadre du projet Horizon Europe PANDORA.
PANDORA fournit des modèles d’« IA en tant que service » (AIaaS) adaptés aux besoins des utilisateurs finaux (par exemple, latence, précision, consommation d’énergie). Ces modèles peuvent être entraînés soit au moment de la conception, soit au moment de l’exécution, à l’aide des données collectées à partir des appareils IoT déployés dans les espaces intelligents.
PANDORA offre aussi des ressources informatiques en tant que service (CaaS) sur l’ensemble du continuum IoT-Edge-Cloud afin de prendre en charge le déploiement des modèles d’IA. Le cadre gère le cycle de vie complet du modèle d’IA, garantissant un fonctionnement continu, robuste et axé sur les intentions des applications AIoT pour les utilisateurs finaux.
Au moment de l’exécution, les applications AIoT sont déployées de manière dynamique sur l’ensemble du continuum IoT-Edge-Cloud, en fonction de mesures de performance, telles que l’efficacité énergétique, la latence et la capacité de calcul. Le CaaS alloue intelligemment les charges de travail aux ressources au niveau le plus approprié (IoT-Edge-Cloud), maximisant ainsi l’utilisation des ressources. Les modèles sont sélectionnés en fonction des exigences spécifiques au domaine (par exemple, minimiser la consommation d’énergie ou réduire le temps d’inférence) et sont continuellement surveillés et mis à jour afin de maintenir des performances optimales.
This work has received funding from the European Union’s Horizon Europe research and innovation actions under grant agreement No. 101135775 (PANDORA) with a total budget of approximately €9 million and brings together 25 partners from multiple European countries, including IISC and UOFT from India and Canada.
23.02.2026 à 17:09
Une nouvelle technique permet (enfin) de révéler les fonds marins côtiers du monde entier
Rafael Almar, Chercheur en dynamique littorale, Institut de recherche pour le développement (IRD)
Erwin Bergsma, Expert en océanographie côtière, Centre national d’études spatiales (CNES)
Sophie Loyer, Ingénieur R&D, Service hydrographique et océanographique de la marine (Shom)
Texte intégral (1678 mots)
Bien connaître les fonds marins est crucial dans de nombreux domaines. Or, jusqu’à présent on ne savait en cartographier qu’une très faible proportion. Une nouvelle méthode permet, en utilisant des satellites, de mesurer les caractéristiques des vagues afin d’estimer la profondeur et donc de mieux connaître les fonds marins à l’échelle des côtes du monde entier.
Nous connaissons bien les cartes topographiques des zones terrestres, avec leurs plaines, vallées, canyons et sommets. La topographie sous-marine est beaucoup moins connue, car elle est difficile à voir et à mesurer. Pourtant, lors du dernier âge glaciaire, lorsque le niveau de la mer se situait 120 mètres plus bas et qu’il était possible de traverser la Manche à pied, ces zones étaient apparentes. Dans le passé, la Méditerranée se serait également asséchée par évaporation, coupant le lien avec l’océan Atlantique à Gibraltar et révélant aux habitants de la Terre de l’époque ses fonds marins. Malheureusement, pour les explorer au sec, il faudrait que les fonds marins se découvrent, mais les prévisions actuelles de changement climatique, liées aux activités anthropiques, indiquent plutôt une hausse du niveau de la mer de l’ordre du mètre pour le XXIe siècle.
Cartographier ces fonds marins est un véritable enjeu actuel pour de multiples aspects : navigation, développement des énergies marines renouvelables (éoliennes, câbles sous-marins), mais aussi sécurité civile et risques de submersion/érosion. Ces mesures sont réalisées au moyen de navires océanographiques équipés de sondes (poids au bout d’un fil, puis échosondeurs), ce qui est coûteux et dangereux notamment lorsqu’il s’agit de s’approcher des petits fonds, en présence de vagues et de courants.
Des fonds encore largement méconnus
En France, c’est le Service hydrographique et océanographique de la Marine (Shom) qui est chargé de la cartographie des fonds marins pour le compte de l’État. Avec près de 11 millions de km2, la France possède la deuxième plus grande zone maritime au monde et le Shom ne peut mesurer qu’environ 1 % de cette surface. Au niveau mondial, seulement environ la moitié des zones côtières ont été mesurées, souvent une seule fois, et ces informations datent souvent de plusieurs décennies. Or, ces fonds peuvent évoluer sous l’action de mouvements tectoniques, de déplacements sédimentaires dus aux vagues et aux courants, aux rivières et aux estuaires, ainsi qu’aux dunes et bancs de sable sous-marins, aux chenaux de navigation, etc. Une réactualisation régulière est donc primordiale. Aujourd’hui, les missions de satellites d’observation de la Terre sont de plus en plus nombreuses, fréquentes et précises, offrant des capacités d’observation inégalées et en constante progression. C’est dans ce contexte que nous avons cherché à développer, avec le programme S2Shores (Satellites to Shores), une approche permettant d’utiliser cette nouvelle opportunité pour cartographier l’ensemble des fonds marins côtiers à l’échelle mondiale par satellite.
Dans un environnement côtier très dynamique, il est essentiel pour la sécurité de la navigation de disposer d’un état actualisé des fonds marins. Cela permet également d’améliorer la précision des modèles de vagues, de marée et de courants, dont les performances dépendent principalement de la connaissance de l’état des fonds marins. Face à l’augmentation des risques de submersion et d’érosion côtières liée au changement climatique, il est essentiel de pouvoir anticiper et prévenir ces phénomènes dans le cadre d’événements extrêmes. Cela permet également de réaliser des bilans sédimentaires en quantifiant les stocks de sable. Dans les pays du Sud, qui ne bénéficient pas de moyens traditionnels coûteux de cartographie des fonds marins, les promesses offertes par ces nouvelles techniques satellitaires, ainsi que les attentes, sont grandes.
Comment fonctionne cette nouvelle méthodologie ?
Les méthodes satellitaires existantes pour estimer les fonds marins sont principalement basées sur l’observation directe du fond : on mesure ce que l’on voit. Cette approche est efficace dans les eaux claires et transparentes, comme dans les atolls, mais elle est moins performante dans les eaux turbides et troubles, comme autour des panaches de rivières, dans les zones sableuses ou vaseuses. En moyenne, on considère que la profondeur atteignable est d’environ 15 mètres. Une calibration avec des mesures sur place, dites in situ, est la plupart du temps nécessaire.
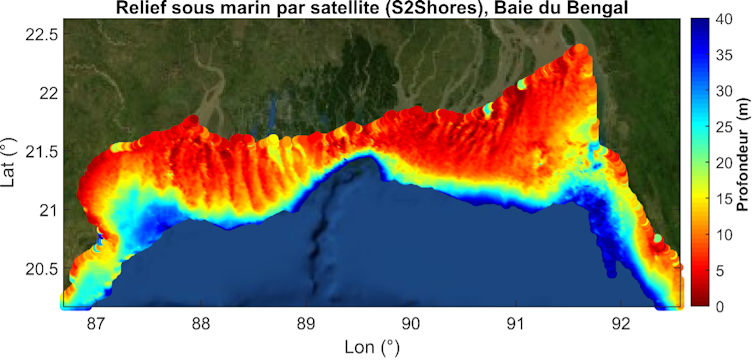
L’approche que nous avons développée est fondée sur une méthode inverse : on mesure les vagues dont les caractéristiques géométriques (longueur d’onde, c’est-à-dire la distance entre deux crêtes) et cinématiques (vitesse) sont modulées par les fonds marins en zone côtière afin d’estimer la profondeur. Cette méthode permet d’étendre le champ d’application des méthodes spatiales aux eaux turbides et plus profondes, jusqu’aux plateaux continentaux, à des profondeurs de plus de 50 mètres, soit une augmentation potentielle de +58 % ou 3,1 millions de km2 par rapport aux méthodes basées sur la couleur de l’eau avec une moyenne mondiale grossière de visibilité des fonds de 15 mètres.
En pratique, nous utilisons les images optiques des satellites de la mission Sentinel-2 de l’Agence spatiale européenne, qui offrent une réactualisation régulière, de l’ordre de cinq à dix jours selon les zones, avec une résolution de 10 mètres. Sentinel-2 dispose de plusieurs bandes de couleur, dont le rouge et le vert, que nous utilisons ici. Ces bandes ne sont pas acquises exactement au même moment. C’est ce décalage d’environ 1 seconde entre ces deux bandes que nous exploitons pour détecter la propagation des vagues, de l’ordre de 1 à 10 mètres par seconde. Tout cela est possible avec un satellite qui passe à environ 700 km d’altitude et 7 km par seconde.
Établir cet atlas global des fonds marins des zones côtières est également une prouesse en termes de traitement de masse de plus d’un million d’images sur le supercalculateur TREX du Cnes, où sont également stockées toutes ces images pour un temps d’accès minimum.
Une chaîne de traitement a été réalisée dans le cadre du programme S2Shores afin d’optimiser ces traitements de manière automatisée.
Nous continuons à faire progresser le cœur du code d’estimation des fonds marins et incorporons différentes missions, comme la récente C03D développée conjointement par le Cnes et Airbus Defence and Space. Après cette démonstration globale à basse résolution (1 km), ces codes sont ouverts et libres d’utilisation pour répondre à des besoins spécifiques, comme des projets d’aménagement, par exemple, ou dans le cadre de jumeaux numériques pour réaliser des scénarios d’inondation ou d’érosion côtière, lorsqu’ils sont combinés à un modèle numérique.
Rafael Almar a reçu des financements de l'Agence Nationale de la Recherche (ANR) à travers le projet GLOBCOASTS (ANR-22-ASTR-0013)
Erwin Bergsma a reçu des financements du CNES.
Sophie Loyer a reçu des financements de l'Agence Nationale de la Recherche (ANR) à travers le projet GLOBCOASTS (ANR-22-ASTR-0013)
23.02.2026 à 11:37
L’IA est conçue pour terminer le travail, pas pour le commencer
Gaurav Gupta, Professor of AI and Digital Entrepreneurship, Neoma Business School
Neha Chaudhuri, Professeur en management de l'information, TBS Education
Texte intégral (1352 mots)

L’IA ne remplace pas la collaboration humaine. C’est un outil qui repose sur le bon timing. Utilisée trop tôt, elle court-circuite la réflexion. Utilisée au bon moment, elle fait gagner du temps. Alors où l’IA est-elle la plus utile dans un projet, de la phase de lancement à la phase de suivi ?
Certains et certaines d’entre nous sont passés par là. Il est 16 h un mardi. Le tableau blanc est couvert de gribouillis, mais la « grande idée » ne vient pas. Le silence règne dans la pièce. L’énergie s’est évaporée dans l’air. Puis, quelqu’un ouvre son ordinateur portable et tape un prompt dans ChatGPT.
L’écran se remplit instantanément de points et de mots. La tension retombe. L’équipe approuve d’un signe de tête : on dirait une stratégie. On dirait un plan d’action. On dirait un progrès.
Mais ce n’est pas le cas.
Une expérience menée par le Boston Consulting Group révèle que cette sensation de soulagement est un piège : les performances de 750 consultants utilisant l’IA ont été inférieures de 23 % à celles de leurs collègues qui n’utilisaient pas l’IA.
Ce n’est pas un cas isolé. Cette expérience est symptomatique d’une incompréhension plus large sur la manière d’utiliser l’intelligence artificielle au bon moment.
C’est pourquoi dans une étude récente impliquant 107 consultants d’une entreprise du classement états-unien Fortune 500, nous avons suivi les performances des équipes utilisant l’IA lors d’un hackathon. Ces dernières devaient élaborer un plan de projet (objectifs, étapes, ressources et délais du projet) pour le lancement d’une nouvelle solution numérique.
Les résultats remettent en question l’idée selon laquelle « il vaut mieux trop que pas assez ». Nous avons constaté que l’IA générative offre une valeur ajoutée pendant la phase d’exécution d’un projet. Cependant, durant la phase critique de lancement, elle offre une valeur négligeable, voire parfois négative.
Le piège de la « moyenne »
Pourquoi un outil fondé sur la somme des connaissances humaines échoue-t-il dès le départ ? La réponse est simple : l’IA excelle dans les schémas préétablis, mais elle est mauvaise pour naviguer dans le flou, ou ce que les sciences de gestion nomment l’ambiguïté.
Lancer un projet nécessite une « pensée divergente ». Vous devez explorer des idées folles et contradictoires pour trouver une proposition de valeur unique.
Nos données montrent que l’IA générative nuit aux performances dans cette phase précise. Cette idée correspond au « principe de pertinence » dans la recherche en management. Comme les grands modèles linguistiques en IA sont des moteurs probabilistes, ils ne peuvent logiquement traduire une discussion spontanée. Le « mot suivant » rédigée par une IA est tiré d’une moyenne statistique des mots probables liés au mot précédent, au lieu d’un mot précis et idoine.
À lire aussi : Pourquoi l’IA oblige les entreprises à repenser la valeur du travail
Si ces algorithmes permettent d’éviter les idées « désastreuses », ils tuent les idées « farfelues ». L’IA rehausse le niveau de qualité minimum d’un projet en nivelant par le bas le niveau de qualité maximum. Vous obtenez un concept soigné, robuste, mais tout à fait moyen.
Moteur du « comment »
Une fois que les humains ont défini le « pourquoi » et le « quoi », l’IA devient le moteur du « comment ».
Comme nous le soulignons dans notre recherche, l’utilisation de l’IA se révèle davantage pertinente pendant les phases de planification et d’exécution. La « planification » consiste à transformer les objectifs en calendriers. L’« exécution » consiste à rédiger les livrables, tels que le code ou les textes marketing.
Deux mécanismes sont à l’origine de cette augmentation des performances lors de ces deux phases précises :
Traducteur des expertises
Des recherches suggèrent que l’IA agit comme un traducteur dans une équipe, notamment pour les experts. Par exemple, elle aide un spécialiste du marketing à rédiger un dossier technique ou un développeur à rédiger un communiqué de presse. Par ricochet, l’IA réduit les coûts de coordination.
Tâches fastidieuses
L’IA se charge des tâches fastidieuses telles que la rédaction de codes standardisés ou de diapositives. Dès lors, les humains peuvent se consacrer à des tâches à forte valeur ajoutée.
Signalement du « patron numérique »
La dernière phase, celle du suivi, recèle un danger caché.
Les outils modernes d’IA peuvent analyser les échanges de courriels, afin de détecter les risques humains autour d’un projet, comme une baisse de moral ou un stress avant qu’une échéance ne soit dépassée.
À lire aussi : Et si votre prochain collègue était un agent IA ?
Une étude sur le marketing d’influence nous met en garde : lorsque les employés se sentent surveillés par des algorithmes, l’authenticité disparaît. Ils commencent à « manipuler les indicateurs », en travaillant pour satisfaire l’IA plutôt que pour atteindre l’objectif.
Si l’IA devient un « patron numérique », la sécurité psychologique s’érode. Les équipes cessent de signaler honnêtement les risques d’un projet pour éviter d’être eux-mêmes signalées par l’IA.
Une stratégie en fonction des étapes
Les dirigeants doivent cesser de considérer l’IA générative comme une solution universelle. Ils doivent plutôt adopter une stratégie en fonction des étapes d’un projet.
Au cours de la phase de lancement
Établissez des « zones réservées aux humains ». Obligez les équipes à définir le problème sans algorithmes.
Au cours de la phase d’exécution
Utilisez l’IA pour faire se comprendre les équipes, notamment les experts, et accélérer les tâches fastidieuses et ingrates.
Au cours de la phase de suivi
Utilisez l’IA pour donner de la visibilité à l’équipe, non pour l’espionner.
Les auteurs ne travaillent pas, ne conseillent pas, ne possèdent pas de parts, ne reçoivent pas de fonds d'une organisation qui pourrait tirer profit de cet article, et n'ont déclaré aucune autre affiliation que leur organisme de recherche.
- GÉNÉRALISTES
- Ballast
- Fakir
- Interstices
- Issues
- Korii
- Lava
- La revue des médias
- Time [Fr]
- Mouais
- Multitudes
- Positivr
- Regards
- Slate
- Smolny
- Socialter
- UPMagazine
- Le Zéphyr
- Idées ‧ Politique ‧ A à F
- Accattone
- À Contretemps
- Alter-éditions
- Contre-Attaque
- Contretemps
- CQFD
- Comptoir (Le)
- Déferlante (La)
- Esprit
- Frustration
- Idées ‧ Politique ‧ i à z
- L'Intimiste
- Jef Klak
- Lignes de Crêtes
- NonFiction
- Nouveaux Cahiers du Socialisme
- Période
- ARTS
- L'Autre Quotidien
- Villa Albertine
- THINK-TANKS
- Fondation Copernic
- Institut La Boétie
- Institut Rousseau
- TECH
- Dans les algorithmes
- Framablog
- Gigawatts.fr
- Goodtech.info
- Quadrature du Net
- INTERNATIONAL
- Alencontre
- Alterinfos
- Gauche.Media
- CETRI
- ESSF
- Inprecor
- Guitinews
- MULTILINGUES
- Kedistan
- Quatrième Internationale
- Viewpoint Magazine
- +972 mag
- PODCASTS
- Arrêt sur Images
- Le Diplo
- LSD
- Thinkerview
